-Tema 1 El trabajo científico
¿Qué es el trabajo científico?
Los científicos tratan de conocer mejor el mundo que nos rodea.
No puede decirse que todos los científicos utilicen un método de trabajo idéntico. La época en la que vivieron condicionó su forma de trabajar.
Si algo caracteriza a un científico es su curiosidady su tendencia a hacer hipótesis sobre cómo se comporta la naturaleza.
Tener curiosidad por saber cómo funciona un ser vivo, qué leyes rigen el movimiento de los planetas, qué fármacos son adecuados para combatir una enfermedad, son sólo algunas de las tareas propias de los científicos y que han conseguido tantos avances en el conocimiento.
Ser curioso no basta para ser científico.
Los científicos deben saber todo lo que ya se conoce sobre lo que quieren investigar.
- Formación.
Conocer todo lo que se sabe de un tema es una tarea larga y complicada, hay que estudiar y trabajar mucho.
- Organización.
Los científicos se organizan en grupos de investigación. Desde sus centros de trabajo, se plantean interrogantes y buscan respuestas a sus preguntas.
El organismo de investigación más importante de España es el Consejo Superior de investigaciones Científicas. En él trabajan más de 20000 personas, de las que más de 3000 son científicos.
¿Sobre qué se puede investigar?
No es fácil que un científico investigue sobre cualquier tema que se le ocurra. Los grupos de investigación deciden cuáles son los temas a investigar.
Los gobiernos y las empresas también tienen mucho que decir sobre qué se investiga. Existen líneas prioritarias de investigación, bien porque se espera que con su desarrollo se encuentren soluciones para mejorar el nivel de vida, aumentar los ingresos, o.., porque para una empresa sea necesario investigar en un determinado campo para aumentar sus ventas.
La prioridades que tiene el gobierno sobre cuáles son los temas prioritarios a investigar se establecen en el Plan Nacional de I+D+i
Las siglas I+D+I significan: Investigación + Desarrollo + Innovación tecnológica. Una explicación más detallada, puedes encontrarlaaquí.
¿Dónde se encuentra la información ?
La búsqueda de información se realiza en libros y en revistas especializadas en el tema. Éstas, publican artículos científicos en los que exponen qué pretenden investigar, cómo lo han hecho, qué resultados han obtenido y qué conclusiones pueden obtenerse de su trabajo. El idioma habitual en estas comunicaciones suele ser el inglés, por lo que el dominio de esta lengua es imprescindible para cualquier científico. Los centros de investigación deben tener buenas bibliotecas y estar suscritos a las revistas de investigación que publican trabajos de su especialidad.
Si después de haber leído y estudiado mucho, los científicos siguen sin encontrar respuesta a sus preguntas, se plantean estrategias para encontrarla:¿qué procedimiento ha de seguirse en la investigación? ¿qué problemas pueden presentarse? y un sin fin de preguntas que ayudarán a planificar unos buenos experimentos que sean reproducibles en cualquier otro laboratorio y produzcan los mismos resultados.
"Mantengo la teoría de que ...", es equivalente a decir "Supongo que..." En el lenguaje científico, la palabra teoría tiene un significado muy diferente al que se utiliza en el lenguaje ordinario: "Una teoría científica es un conjunto de conocimientos que pueden abarcar varias leyes" Las teorías científicas explican las regularidades que describen las leyes científicas. Estos son dos ejemplos de teorías científicas: Teoría geocéntrica Teoría heliocéntrica |
Si los científicos encuentran respuestas a sus preguntas, publican sus trabajos en las revistas de investigación para el conocimiento de los investigadores interesados. Cuando el tema es lo suficientemente extenso publican libros en los que desarrollan sus trabajos con detalle.
Se dice que la ciencia tiene un carácter acumulativo, pues va progresando a partir de los conocimientos anteriores.
Cuando el resultado de una investigación pudiera tener una aplicación tecnológica inmediata, se registra una patente. La aplicación de esta patente en una empresa, requerirá del permiso de los investigadores, siendo compensados mediante una retribución económica.
El Consejo Superior de Investigaciones Científicas publica numerosas revistas en las que se publican las investigaciones realizadas. Puedes verlas pulsando aquí.
Variables
Se denomina variable a cada uno de los factores que se pueden modificar en los experimentos, con la intención de que esta modificación produzca cambios en los resultados.
Los experimentos no pueden realizarse modificando todas las variables a la vez. Hay que modificarlas una a una, dejando fijas las demás y viendo qué efectos produce sobre lo que queremos comprobar.
La variable que el científico modifica conscientemente se llama variable independiente.
La variable que el científico modifica conscientemente se llama variable independiente.
La variable que se modifica como consecuencia de cambiar la variable independiente se llama variable dependiente. En la escena adjunta esta variable es el periodo de oscilación del péndulo.
Las variables que se mantienen con un valor constante mientras se modifican la variable independiente y la dependiente, se llaman variables de control.
Tablas de valores
Para poder analizar los datos que se obtienen en una experiencia, es preciso recogerlos de una manera ordenada. Así, se consigue que "de un vistazo" puedan verse los resultados de una experiencia.
Representaciones gráficas
Una vez recogidos los valores de las variables en las tablas, el paso siguiente es la representación gráfica.
El Sistema Internacional de Unidades
Se llaman magnitudes a las propiedades de la materia que se pueden medir de una manera objetiva.
Para medir hay que comparar la propiedad que se quiere medir con otra denominada unidad. Por ejemplo, medir la longitud de un cordel, supone conocer cuántas unidades de longitud (metros) tiene dicho cordel.
Siete magnitudes físicas, solas o combinadas, son suficientes, para expresar las propiedades de la materia más habituales. Se llamanmagnitudes fundamentales.
El Sistema Internacional de Unidades es un acuerdo internacional, por el que se establece cuáles son las unidades de las magnitudes fundamentales.
|
| ||||||||||||||||||||||||||||||
El Sistema Internacional de Unidades
Hay magnitudes que pueden expresarse como una combinación de la magnitudes fundamentales:
Estas magnitudes se llaman magnitudes derivadas y las unidades en las que se miden, se llaman unidades derivadas.
En la tabla adjunta puedes ver algunas de las más utilizadas en física.
La medida
|
| |||||||||||||||||||||||||||||
Múltiplos y submúltiplos
En muchas ocasiones, y dado que carece de sentido expresar el resultado de una medida en la unidad correspondiente del Sistema Internacional, se recurre al empleo de múltiplos y submúltiplos.
No tendría mucho sentido expresar la distancia entre la Tierra y la Luna en metros, ni tampoco sería adecuado utilizar esta unidad para medir el grosor de un cabello.
La tabla adjunta contiene los múltiplos y submúltiplos del Sistema Internacional de Unidades.
Puesto que hay medidas tan grandes y tan pequeñas, para facilitar los cálculos, las medidas suelen expresarse mediante lo que se conoce como notación científica.
Notación científica
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Se llama precisión de un instrumento de medida a la variación más pequeña que dicho instrumento puede apreciar.
Exactitud: un instrumento de medida es tanto más exacto cuanto más se acerquen sus medidas al valor real.
Rango de un instrumento de medida es el intervalo entre el valor mínimo y máximo que puede medir dicho instrumento.
Fidelidad: un instrumento de medida es tanto más fiel cuanto al realizar varias veces una medida, se produzcan los mismos resultados.
Errores en la medida
Error absoluto
El error absoluto de una medida es la diferencia entre el valor real de una magnitud y el valor que se ha
medido. Se llama imprecisión absoluta a la media de los errores absolutos tomados todos con signos positivos.
Error relativo
El error relativo de una medida es elcociente entre el error absoluto de la medida y el valor real de ésta.
El error relativo suele expresarse en %.
El cálculo del error relativo en un proceso de medida nos aporta más información que el simple cálculo del error absoluto. Imagina que el error al medir el lado de un azulejo ha sido 2 mm y el error al medir la longitud de una habitación ha sido también 2mm. Aunque el error absoluto en ambas medidas es el mismo, la medida de la cocina es mucho mejor que la del azulejo, ya que la medida era mucho mayor.
Cifras significativas
Se denominan cifras significativas a todos aquellos dígitos de un número que se conocen con seguridad
(o de los que existe una cierta probabilidad). Cuando el cero aparece a la izquierda de la coma decimal, no se considera cifra significativa. Tampoco si aparece tras la coma, si delante no tiene algún número distinto de cero.
En la medida expresada como 4,563 m, si conocemos con seguridad hasta la 4ª cifra. Nos da
idea de que el instrumento con que se ha medido esta longitud puede apreciar hasta los milímetros. Esta medida tiene cuatro cifras significativas.
Medir es comparar. Las propiedades que se miden en él ámbito científico se llaman magnitudes
que se miden expresando su resultado en unidades. El sistema Internacional de Unidades es un acuerdo entre estados, donde se decide con qué comparar. Puesto que las medidas tienen un rango de posibilidades enormes, habitualmente se utilizan múltiplos y submúltiplos de ellas. La notación científica es la forma habitual de expresar la medida de magnitudes. Medir es comparar. Las propiedades que se mide, hay que considerar qué características tiene el instrumento de medida. Los instrumentos pueden ser analógicos o digitales y entre sus características están su precisión, fidelidad, exactitud y rango.
En cualquier proceso de medida se cometen errores. La forma de disminuir los errores es realizar muchas medidas y estimar cuál sería el valor que más se aproxima al "real". Se habla de incertidumbre absoluta y de error relativo, para hacernos una idea. -Tema 2 Materia,Calor, la temperatura Propiedades
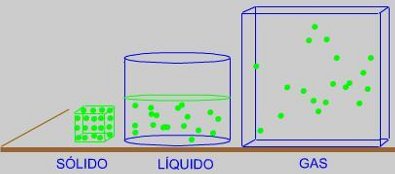
La materia que nos rodea aparece ante nosotros con muy diversos aspectos.
Presenta distintas formas, colores, dureza, fluidez..., pero en general consideraremos
que lo hace en los siguientes estados:
SÓLIDO, LÍQUIDO y GAS
Aspectos cualitativos Antecedentes históricos: Los filósofos griegos, Demócrito y Epicuro, consideraban que la materia es divisible en la experiencia diaria, pero, en un cierto término, consta de partículas indivisibles que podemos provisionalmente llamar átomos (de la palabra griega átomo, indivisible). El físico inglés J. Dalton (1766-1844) establece laTeoría atómica de la materia en la que se considera que todo tipo de materia, sea sólido, líquido o gas, está constituida por partículas, que en principio se llamaron átomos. En un SÓLIDO, estas "partículas" ocupan posiciones determinadas en una red, alrededor de las cuales vibran cada vez más intensamente a medida que aumentamos la temperatura. Las fuerzas atractivas entre las partículas del sólido son muy intensas. En un LÍQUIDO, estas "partículas" se mueven deslizándose unas cerca de otras y manteniéndose unidas por débiles fuerzas atractivas entre ellas. En el caso de un GAS, estas "partículas" se mueven a grandes velocidades y las fuerzas atractivas entre ellas podemos considerarlas como inexistentes. Se mueven al azar ocupando todo el volumen del recipiente.
Como vamos a estudiar el comportamiento de los gases, vamos a establecer un MODELO para cualquier gas, que, como hemos visto en las anteriores animaciones, estará constituido por partículas moviéndose al azar y chocando contra las paredes del recipiente. Las características de nuestro MODELO ideal de gas serán:
-Las partículas del gas son pequeñísimas comparadas con el volumen del recipiente.
-Se mueven al azar con distintas velocidades de manera que, si aumenta la temperatura, aumenta la
velocidad de las partículas del gas.
- No existen fuerzas de atracción entre ellas.
- En su movimiento, chocan entre ellas y con las paredes del recipiente cumpliéndose las leyes de los
choques elásticos.
- Cuando chocan aparecen las fuerzas o interacciones entre ellas o con las paredes del recipiente.
- Los choques con las paredes del recipiente producen el efecto que llamamos presión sobre las mismas.
Actividad interactiva Presión. Unidades
Se define la magnitud física llamada PRESIÓN como una fuerza por unidad de superficie, es decir:
Su unidad en el Sistema Internacional (SI) , es el PASCAL y cuyo símbolo es Pa y equivale a:
Pa = 1N/1m2
Factores que regulan la presión
Como hemos visto, la PRESIÓN que ejerce un gas sobre las paredes del recipiente, depende de
tres factores:
Del nº de partículas de gas (cantidad de gas considerada). A más partículas más presión.
Delvolumen del recipiente. A mayor volumen, menor presión. De la temperatura del gas.
A mayor temperatura, mayor velocidad de las partículas del gas y por tanto mayor presión.
Es decir: P = f ( V , t , nº de partículas)
Si queremos comprobarlo experimentalmente, como la presión depende de tres variables,
tendremos que planear experiencias en las que, manteniendo constantes dos de ellas,
variemos sólo una de ellas. Eso es lo que hicieron Boyle, Gay-Lussac y Charles
1ª Experiencia. Manteniendo constante la cantidad de gas (nº de partículas) y la temperatura
del gas, variaremos del volumen del gas y para cada volumen mediremos la presión : nº part=cte,
t = cte, P =f(V). Con ella llegaremos a la ley de BOYLE.
2ª Experiencia. Manteniendo constante la cantidad de gas (nº de partículas) y el Volumen del
recipiente, variaremos la temperatura en ºC del gas y, para cada temperatura mediremos la
presión: nº part=cte, V=cte, P=f(t). Con ella llegaremos a la ley de GAY-LUSSAC.
3ª Experiencia. Manteniendo constantes el volumen del recipiente y la temperatura del
gas, variaremos el nº de partículas del gas, y para cada valor mediremos la presión:
V=cte, t=cte, P=f(nº de partículas), con ella podremos completar la ecuación de estado
del gas IDEAL.
TEORÍA CINÉTICA interactiva   Escala absoluta
Con nuestra 2ª experiencia, vamos a llegar a la ley de Gay-Lussac y a la escala absoluta de
temperaturas. Esta experiencia consta de 3 pasos: calentar el gas, enfriarlo y obtener el cero
absoluto de temperaturas. Recordemos que se trata de ver cómo varía la presión del gas al ir
variando la temperatura, manteniendo constante el volumen del recipiente. Para ello,
introduciremos la misma cantidad de gas en un recipiente cerrado (sin émbolo) e iremos
calentándolo con un mechero de gas o con una resistencia eléctrica y, midiendo la presión del
gas para distintas temperaturas.
Al aumentar la temperatura en ºC,
la presión del gas irá aumentando hasta que sea tan grande que las paredes del recipiente
no soporten la presión del gas y estalle.
En esta experiencia la presión del gas parece depender linealmente de la temperatura en ºC.
En esta 2ª Experiencia, al disminuir latemperatura del gas refrigerándolo, vemos que disminuye
progresivamente la presióndel mismo, ya que, a menor temperatura las partículas del gas se
mueven cada vez más lentamente. Si continuamos disminuyendo la temperatura, la presión
también irá disminuyendo, pero el problema reside en que muy bajas temperaturas como
-100 o -200ºC son difíciles de conseguir. En nuestra experiencia, la temperatura más baja será
-200ºC.
En esta experiencia la presión del gas parece depender linealmente de la temperatura en ºC.
Si dibujamos esta línea recta, cortará en algún punto al eje de las x (en nuestro caso
temperatura en ºC)
En esta 2ª Experiencia, temperaturas bajísimas de -250ºC o menores no se pueden conseguir.
Pero como nuestra relación entre la temperatura en ºC y la presión es una relación lineal, podemos
prolongar la recta de la gráfica hasta que corte al eje de las x, que en este caso es el eje en el
que hemos puesto la temperatura en ºC. Este punto resulta ser -273ºC, que será la temperatura
a la cual las partículas del gas estarán en reposo. Esta temperatura, llamada cero grados absolutos
de temperatura, no se puede alcanzar en ningún caso (por un principio de la Termodinámica),
podremos aproximarnos a ella pero NO alcanzarla.
Si establecemos el origen de coordenadas en esa temperatura de -273ºC y la llamamos 0 grados absolutos o 0 Kelvin, nuestra nueva escala de temperaturas la llamaremosescala absoluta de temperaturas, y los valores los obtendremos sumando a la temperatura en ºC el valor de 273.
T (K) = t (ºC) + 273
En 1967 se adoptó la temperatura del punto triple del agua como único punto fijo para la definición de la escala absoluta de temperaturas y la separación centígrada de la escala Celsius. El nivel cero quedaba a -273,15 K del punto triple y se definía como el cero absoluto o 0 K. Esta escala sustituyó a la escala centígrada o Celsius al definir el cero como el punto más bajo posible e inalcanzable en la práctica. A la temperatura del cero absoluto no hay movimiento y desde él no se puede sacar calor. En ese estado todo el movimiento atómico y molecular se detiene, es la temperatura más baja posible. Todos los objetos tienen una temperatura más alta que el cero absoluto y por lo tanto emiten energía térmica o calor. El espacio interestelar casi vacío tiene temperatura ligeramente superior al 0 K.  En este esquema comparativo puedes ver las escalas En este esquema comparativo puedes ver las escalasmás Conversión de valores de temperaturas La escala Celsius y la escala Kelvin tiene una transformación muy sencilla:grados K=273.15 + grados C En la transformación de grados centígrados a grados Fahrenheit debes tener en cuenta que cada grado centígrado vale 1,8 ºF ( 0 - 100 en la escala centígrada equivale a 32 - 210 en la escala Fahrenheit). Por lo tanto debes multiplicar los grados centígrados por 1,8 que equivale a 9/5 . Como el cero Celsisus corresponde al 32 Fahrenheit debes sumar 32:gradosF=(9/5)*gradosC+32gradosC=(5/9)*( grados F-32) Para la transformación inversa se despeja y queda: Programa aplicación con él puedes realizar conversiones de grados F a Celsius. lCalor y temperatura
Calor y temperatura.Laboratorio
Escalas termométricas TERMOMETRO Calor y energía molecular Ley de Gay-Lussac
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
..Tema 5 ..............................................El átomo
1. El átomo a través de la historia
Las primeras teorías atomistas (I)
¿Qué ocurriría si dividiéramos un trozo de materia muchas veces? ¿Llegaríamos hasta una parte indivisible o podríamos seguir dividiendo sin parar?
Los filósofos de la antigua Grecia discutieron bastante sobre este tema. El problema es que estos filósofos no utilizaban ni la medición ni la experimentación para llegar a conclusiones, por tanto, no seguían las fases del método científico.
De esta forma, se establecieron dos teorías:atomista y continuista, que se basaban en la existencia de partes indivisibles o en que siempre se podía seguir dividiendo.
Las primeras teorías atomistas (II)
En el siglo V a.C., Leucipo pensaba que sólo había un tipo de materia. Sostenía, además, que si dividíamos la materia en partes cada vez más pequeñas, acabaríamos encontrando una porción que no se podría seguir dividiendo. Un discípulo suyo, Demócrito, bautizó a estas partes indivisibles de materia con el nombre deátomos, término que en griego significa “que no se puede dividir”.
Los atomistas pensaban que:
- Todo está hecho de átomos. Si dividimos una sustancia muchas veces, llegaremos a ellos.
- Las propiedades de la materia varían según como se agrupen los átomos.
- Los átomos no pueden verse porque son muy pequeños.
Las primeras teorías atomistas (III)
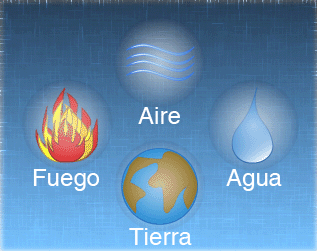
Aristóteles rechazó la teoría atomista y estableció que la materia estaba formada por cuatro elementos: tierra, agua, aire y fuego, esta teoría se llamó continuista. Gracias al prestigio que tenía, se mantuvo vigente en el pensamiento de la humanidad durante más de 2000 años.
Los continuistas pensaban que:
- Los átomos no existen. No hay límite para dividir la materia.
- Si las partículas, llamadas átomos, no pueden verse, entonces es que no existen.
- Todas las sustancias están formadas por las combinaciones de los 4 elementos básicos: agua, aire, tierra y fuego. El quinto elemento.
Teoría atómica de Dalton
 En 1808, John Dalton publicó su teoría atómica, que retomaba las antiguas ideas de Leucipo y Demócrito pero basándose en una serie de experiencias científicas de laboratorio.
En 1808, John Dalton publicó su teoría atómica, que retomaba las antiguas ideas de Leucipo y Demócrito pero basándose en una serie de experiencias científicas de laboratorio.
La teoría atómica de Dalton se basa en los siguientes enunciados:
- La materia está formada por átomos, que son partículas indivisibles e indestructibles.
- Todos los átomos de un mismo elemento químico son iguales en masa y propiedades y diferentes de los átomos de cualquier otro elemento.
- Los compuestos se forman por combinaciones de átomos de diferentes elementos
| 2. Estructura atómica | |
Fenómenos eléctricos
Algunos fenómenos de electrización pusieron de manifiesto la naturaleza eléctrica de la materia. Para explicar estos fenómenos, los científicos idearon un modelo según el cual los fenómenos eléctricos son debidos a una propiedad de la materia llamada carga eléctrica.
Las propiedades de los cuerpos eléctricos se deben a la existencia de dos tipos de cargas: positiva y negativa.
Dos cuerpos que hayan adquirido una carga del mismo tipo se repelen, mientras que si poseen carga de distinto tipo se atraen.
En general, la materia es eléctricamente neutra, es decir, tiene la misma cantidad de cada tipo de carga. Si adquiere carga, tanto positiva como negativa, es porque tiene más cantidad de un tipo que de otro.
|
El átomo es divisible
A comienzos del siglo XIX se presentaba la siguiente situación:
- Dalton había demostrado que la materia estaba formada por átomos.
- Existían experiencias de fenómenos eléctricos que demostraban que la materia podía ganar o perder cargas eléctricas.
- Dalton había demostrado que la materia estaba formada por átomos.
- Existían experiencias de fenómenos eléctricos que demostraban que la materia podía ganar o perder cargas eléctricas.
Por tanto, esas cargas eléctricas debían de estar de alguna forma en el interior de los átomos. Si esto era cierto, la teoría de Dalton era errónea, ya que decía que los átomos eran indivisibles e inalterables.
Debido a que no podían verse los átomos, se realizaron experimentos con tubos de descargao tubos de rayos catódicos y así, de esta manera, se observaron algunos hechos que permitieron descubrir las partículas subatómicas del interior del átomo.
El descubrimiento del electrón
Es la primera partícula subatómica que se detecta.
El físico J. J. Thomson realizó experiencias en tubos de descarga de gases. Observó que se emitían unos rayos desde el polo negativo hacia el positivo, los llamó rayos catódicos.
Al estudiar las partículas que formaban estos rayos se observó que eran las mismas siempre, cualquiera que fuese el gas del interior del tubo. Por tanto, en el interior de todos los átomos existían una o más partículas con carga negativa llamadas electrones.
Los electrones tienen carga negativa.
|

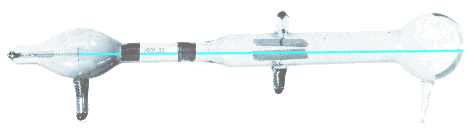
El descubrimiento del protón
El físico alemán E. Goldstein realizó algunos experimentos con un tubo de rayos catódicos con el cátodo perforado. Observó unos rayos que atravesaban al cátodo en sentido contrario a los rayos catódicos. Recibieron el nombre derayos canales.
El estudio de estos rayos determinó que estaban formados por partículas de carga positiva y que tenían una masa distinta según cual fuera el gas que estaba encerrado en el tubo. Esto aclaró que las partículas salían del seno del gas y no del electrodo positivo.
Al experimentar con hidrógeno se consiguió aislar la partícula elemental positiva o protón, cuya carga es la misma que la del electrón pero positiva y su masa es 1837 veces mayor.
Los protones tienen carga positiva.
|
El descubrimiento del neutrón
Mediante diversos experimentos se comprobó que la masa de protones y electrones no coincidía con la masa total del átomo; por tanto, el físico E. Rutherford supuso que tenía que haber otro tipo de partícula subatómica en el interior de los átomos.
Estas partículas se descubrieron en 1932 por el físico J. Chadwick. Al no tener carga eléctrica recibieron el nombre de neutrones. El hecho de no tener carga eléctrica hizo muy difícil su descubrimiento.
Los neutrones son partículas sin carga y de masa algo mayor que la masa de un protón.
Los neutrones no tienen carga eléctrica.
| ||||||||||||||||||||
| 3. Modelos atómicos |
Modelo de Thomson (I)
Al ser tan pequeña la masa de los electrones, el físico J. J. Thomsonpropuso, en 1904, que la mayor parte de la masa del átomo correspondería a la carga positiva, que ocuparía la mayor parte del volumen atómico. Thomson imaginó el átomo como una especie de esfera positiva continua en la que se encuentran incrustados los electrones, más o menos como las uvas pasas en un pudin.
Este modelo del “pudin de pasas” de Thomson era bastante razonable y fue aceptado durante varios años, ya que explicaba varios fenómenos, por ejemplo los rayos catódicos y los canales:
Experimento de Rutherford
En 1911, E. Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (positivas), procedentes de un material radiactivo, a gran velocidad. El experimento permitió observar el siguiente comportamiento en las partículas lanzadas:
La mayor parte de ellas atravesaron la lámina sin cambiar de dirección, como era de esperar. Algunas se desviaron considerablemente. Unas pocas partículas rebotaron hacia la fuente de emisión.
El comportamiento de las partículas no podía ser explicado con el modelo de Thomson, así que Rutherford lo abandonó y sugirió otro basado en el átomo nuclear.
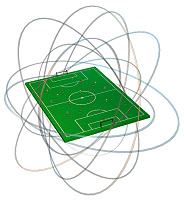
Tamaño atómico
Distintas experiencias han permitido medir el tamaño de los átomos. Considerado como una esfera, el átomo tiene un radio de unos 10-10 m y el núcleo tiene un radio de unos 10-14 m. De aquí se puede deducir que el núcleo es unas 10000 veces más pequeño que el átomo.
Para hacernos una idea: si el átomo fuera del tamaño de un campo de fútbol, el núcleo sería como un guisante colocado en su centro, y los electrones se encontrarían en las gradas girando alrededor del campo.
| El núcleo es 10000 veces menor que elátomo. |
Entre el núcleo y la corteza, hay espacio vacío, donde no hay absolutamente nada.
4. Identificación de átomos
Números Atómico y Másico
La identidad de un átomo y sus propiedades vienen dadas por el número de partículas que contiene. Lo que distingue a unos elementos químicos de otros es el número de protones que tienen sus átomos en el núcleo. Este número se llama Número atómico y se representa con la letra Z. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente.
El Número másico nos indica el número total de partículas que hay en el núcleo, es decir, la suma de protones y neutrones. Se representa con la letra A y se sitúa como superíndice a la izquierda del símbolo del elemento. Representa, aproximadamente, la masa del átomo medida en uma, ya que la de los electrones es tan pequeña que puede despreciarse
Iones
Un ion se representa mediante el símbolo del elemento del que procede, con un superíndice a la derecha, que indica la carga que posee mediante un número y el signo + o el signo -.
Los cationes han perdido electrones en el número que indica la carga positiva. Por ejemplo, +3 indicará que ese átomo ha perdido 3 electrones.
Los aniones han ganado electrones, en el número que indica la carga negativa. Por ejemplo, -2 indicará que ese átomo ha ganado 2 electrones.
5. Isótopos y Masa atómica
Isótopos
Todos los átomos de un elemento químico tienen el mismo número de protones, pero pueden diferenciarse en el número de neutrones.
Se llaman Isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Por tanto, presentan el mismo número atómico (Z) y diferente número másico (A).
Los isótopos tienen masa diferente, ya que tienen distinto número de neutrones.
Para nombrarlos se indica su nombre seguido de su número másico; por ejemplo, sodio-23 (Na-23), hidrógeno-3 (H-3), carbono-14 (C-14).
|
Masa atómica
La masa atómica de un elemento es la que corresponde al promedio de las masas de sus distintos isótopos según las abundancias relativas naturales de estos en dicho elemento. Hay que tener en cuenta las masas de los distintos isótopos y sus porcentajes en la naturaleza.
Ya que la unidad de masa del SI, el kg, es demasiado grande, se define la llamada unidad de masa atómica (uma) que es la doceava parte de la masa del isótopo de carbono-12 (1 uma = masa del carbono-12/12). Se divide la masa del C-12 (que tiene 6 protones y 6 neutrones) entre 12. Esta unidad sí es del tamaño de los átomos.
Lo que se hace es medir la masa de los átomos de todos los elementos en uma. Para ello, se compara la masa de cualquier elemento con la masa del carbono-12 dividida entre 12. Por ejemplo, la masa del oxígeno es 16 uma, lo que indica que su masa es 16 veces mayor que la del carbono-12 dividida entre 12.
Las masas atómicas de los elementos están calculadas y aparecen como datos en la Tabla Periódica.
Cálculo de la Masa Atómica
Como hemos visto, no todos los átomos de un elemento son exactamente iguales. La mayoría de los elementos presentan diferentes isótopos y esto hay que considerarlo para calcular la masa atómica.
La masa atómica de un elemento es la masa media ponderada de sus isótopos naturales. Por eso, la masa atómica de un elemento no es un número entero. La media ponderada quiere decir que no todos los isótopos tienen el mismo porcentaje.
Veamos un ejemplo:
El cloro tiene dos isótopos: Cl-35 en un 75,5 % y Cl-37 en un 24,5 %. Por tanto, la masa atómica media será:
M.a.= 35 uma · 75,5/100 + 37 uma · 24,5/100 = 35,49 uma. Esta masa atómica es la que aparecerá en la tabla periódica para el cloro
Radiactividad
La radiactividad es un fenómeno en el cual, los núcleos de átomos que no son estables (suelen ser aquellos que tienen un número de neutrones muy superior al de protones), emiten partículas y radiaciones de forma espontánea hasta que consiguen estabilizarse. Esto hace que los núcleos de un elemento se transformen en núcleos de otro elemento diferente. Estos núcleos de isótopos radiactivos se denominanradioisótopos.
Las partículas y radiaciones que pueden ser emitidas son:
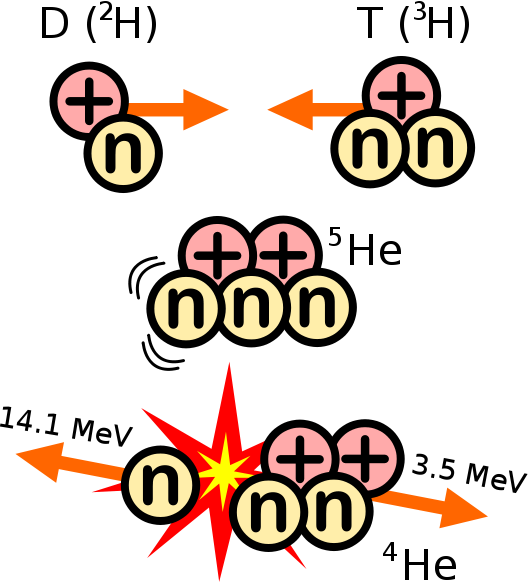
- Partículas alfa (α): Formadas por 2 protones y 2 neutrones (núcleos de helio). Su carga es positiva y son emitidas a gran velocidad. Tienen poco poder de penetración.
- Partículas beta (β): Son electrones que se desplazan a gran velocidad. Tienen mayor poder de penetración que las partículas alfa.
- Rayos gamma (γ): Son radiaciones de alta energía, que se propagan a la velocidad de la luz. Son muy penetrantes, sólo son detenidos por gruesas capas de plomo u hormigón.
Fisión nuclear
Fisión nuclear
La fisión nuclear consiste en la rotura de núcleos de átomos "grandes" mediante bombardeo con neutrones, dando lugar a dos o más núcleos de átomos "pequeños" y algunas otras partículas. Además se libera gran cantidad de energía.
El proceso comienza al bombardear el núcleo grande con partículas como neutrones. (Los neutrones son buenos proyectiles ya que al no tener carga son menos rechazados por parte del núcleo). Además de núcleos de elementos con átomos más pequeños, se liberan otros neutrones que rompen otros núcleos grandes, en lo que se denomina una reacción en cadena.
La gran cantidad de energía que se libera se llama energía nuclear. Esta energía se aprovecha en las centrales nucleares para obtener energía eléctrica. También es la responsable del efecto destructivo de lasbombas atómicas y de los misiles nucleares.
 |
Aplicaciones de los Radioisótopos
Los Radioisótopos son isótopos radiactivos de un elemento. Por ejemplo, el 3H es un isótopo radiactivo del 1H.
Las aplicaciones de los radioisótopos se basan en que un isótopo radiactivo es, desde el punto de vista físico y químico, exactamente igual a su isótopo no radiactivo y se comporta de la misma forma en cualquier proceso físico o químico en el cual participe. La ventaja es que se trata de un átomo "marcado" y puede ser seguido en todas sus reacciones químicas y/o biológicas gracias a las radiaciones que emite.
Teniendo en cuenta estas características de los radioisótopos, se pueden emplear para tres aplicaciones fundamentalmente, como son:
- Fuente de energía.
- Investigaciones científicas.
- Aplicaciones médicas.
Aplicaciones como fuentes de energía
Aplicaciones como fuentes de energía
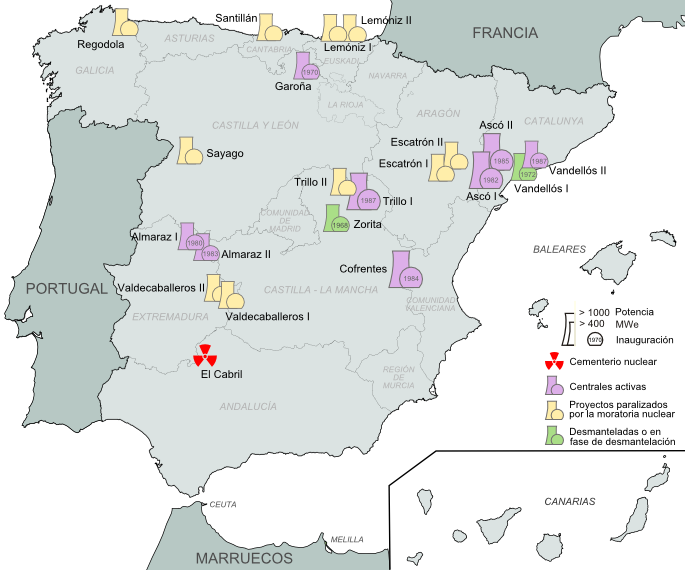
En las Centrales nucleares se obtienen grandes cantidades de energía aprovechando la fisión de ciertos isótopos. Los isótopos más empleados en estas centrales son el uranio-235 y el plutonio-239.
Otra de las formas de aprovechamiento de la energía nuclear, es en la fabricación de pilas de muy larga duración. Uno de los isótopos más empleados es el plutonio-238. Estas pilas se colocan en lugares de difícil acceso o que no pueden ser cambiadas con frecuencia, como por ejemplo: en marcapasos, en estaciones marítimas o en sondas espaciales.
Aplicaciones en Investigación científica
Para determinar la antigüedad de un hallazgo arqueológico. Cada isótopo se desintegra a un ritmo, que depende del número de átomos presentes en la muestra y de su tipo. Se puede medir la velocidad a la que estos isótopos emiten radiación mediante un Contador Geiger. Así conoceremos la edad del material. Por ejemplo, la datación mediante la prueba del carbono-14.
Se utilizan como rastreadores o marcadores, para saber en qué se transforma exactamente una sustancia enuna reacción química. Estas investigaciones son muy importantes para conocer cómo ocurren las reacciones en los seres vivos. Por ejemplo, si tomamos un vaso de agua con sal (NaCl) que contenga al isótopo sodio-24, podemos observar que el sodio tarda sólo 75 segundos en llegar a la superficie de nuestra piel, por transpiración.
Aplicaciones médicas
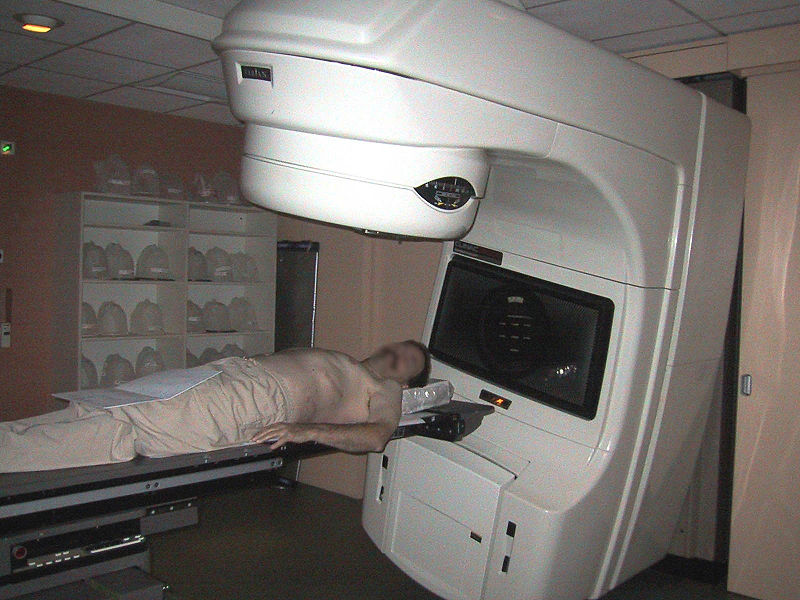
Para diagnosticar algunas enfermedades se introduce en los enfermos (bebiendo o inyectando un líquido) una sustancia que contiene un isótopo radiactivo que emita radiación con poca energía. La sustancia se fija en el órgano que se desea estudiar y, así, se puede observar, por la radiación que emite. La radiación se detecta con aparatos como lacámara de rayos gamma. Por ejemplo, el tecnecio-99 se emplea en el diagnóstico de enfermedades óseas. Para ello se suministra con compuestos de fósforo que se fijan en los huesos.
Para curar ciertos tipos de cáncer. Debido a que el cáncer hace que algunas células se reproduzcan rápidamente, los radioisótopos atacan a este proceso de reproducción celular. Las radiaciones que emiten estas sustancias destruyen más células cancerosas que células normales. En esto consiste la radioterapia. Por ejemplo, el cobalto-60 es uno de los radioisótopos más empleados en la terapia contra el cáncer. También el yodo-131, que es un emisor de partículas beta y gamma, es eficaz para tratar el cáncer de tiroides, ya que el yodo se fija en esta glandula.
En cualquier proceso en el que se utilicen isótopos radiactivos se generan residuos, que hay que someter a un tratamiento y almacenarlos. Estos residuos pueden ser restos de combustible nuclear o materiales usados para el diagnóstico o el tratamiento de enfermedades. Puede ser residuo cualquier objeto que haya estado en contacto con el material radiactivo y se pueda haber contaminado.
Los residuos radiactivos presentan dos propiedades:
- Son muy peligrosos, ya que pequeñas cantidades de residuo pueden emitir radiación peligrosa para nuestra salud.
- Son muy duraderos, ya que pueden emitir radiación cientos o miles de años después.
Pueden ser residuos de baja, media y alta actividad. Los de baja y media actividad dejan de ser nocivos pasados unos 300 años como máximo. Los de alta tardan miles de años en dejar de ser peligrosos. Estos últimos proceden de centrales o de armas nucleares.
1. Elementos
¿Qué es un elemento?
Como sabemos, un elemento es una sustancia pura que no se puede separar más en otras más simples por métodos (reacciones) químicos.
Cada elemento químico está constituido por átomos con las mismas propiedades químicas como la reactividad, el potencial de ionización...
Los elementos químicos se identifican mediante nombres dados en la antigüedad, derivados de alguna propiedad de los mismos, del nombre de su descubridor, del lugar de descubrimiento...
En la naturaleza existen 92 elementos que se pueden presentar (a 1 atm de presión y 25 ºC) como sólido: hierro, plomo; líquido: bromo, mercurio o gas: cloro, oxígeno...
En los laboratorios se ha conseguido sintetizar algunos elementos como el tecnecio.
Los átomos de un mismo elemento tienen las mismas propiedades químicas.
Metales y no metales
Hay algunas propiedades semejantes entre ciertos elementos, esto permite que los podamos clasificar en metales y no metales.
Los metales:
· Son sólidos a temperatura ambiente (excepto el mercurio).
· Reflejan la luz de una forma característica (brillo metálico).
· Son dúctiles y maleables, ya que se pueden estirar en hilos y hacer planchas o láminas fácilmente.
Los no metales:
· No tienen brillo metálico.
· Pueden ser sólidos, líquidos o gases a temperatura ambiente.
· No conducen la electricidad.
· En general son frágiles.
Una primera clasificación de los elementos puede ser dividirlos en metales y no metales. |
2. Clasificación de los elementos
Breve historia
Ley de las tríadas
En 1817 Johann Döbereiner observó que el peso atómico del estroncio era aproximadamente la media entre los pesos del calcio y del bario, elementos que poseen propiedades químicas similares. En 1829, propuso que en la naturaleza existían tríadas de elementos de forma que el central tenía propiedades que eran una media de los otros dos miembros de la tríada.
Ley de las Octavas
En 1864, John Newlands publicó su versión de la tabla periódica clasificando los 56 elementos y estableciendo 11 grupos basados en propiedades físicas similares. Vio que entre los elementos con propiedades similares existían diferencias en la masa atómica relacionadas con múltiplos de ocho. Su ley establecía que un elemento dado presentaría unas propiedades análogas al octavo elemento siguiendo la tabla.
En 1864, John Newlands publicó su versión de la tabla periódica clasificando los 56 elementos y estableciendo 11 grupos basados en propiedades físicas similares. Vio que entre los elementos con propiedades similares existían diferencias en la masa atómica relacionadas con múltiplos de ocho. Su ley establecía que un elemento dado presentaría unas propiedades análogas al octavo elemento siguiendo la tabla.
Antes del descubrimiento de la tabla periódica actual se hizo muchos intentos de clasificación de los elementos.
La tabla de Mendeleiev
Esta tabla consiste, en síntesis, en disponer los elementos químicos en un cuadro en orden creciente de sus masas atómicas notándose una analogía en sus propiedades cada cierto número de elementos (por eso se denomina tabla periódica).
Mendeleiev demostró que los elementos con propiedades químicas semejantes aparecían periódicamente, dando lugar a ocho grupos. En algunos lugares faltaba un elemento, pero Mendeleiev no dudó en predecir su existencia y su comportamiento químico, lo que posteriormente se confirmó.
Mendeleiev ordenó su tabla en orden creciente de las masas atómicas de los elementos.
Mendeleiev ordenó su tabla en orden creciente de las masas atómicas de los elementos.
La tabla periódica actual
Aunque está basada en la propuesta por D. Mendeleiev en 1869, el criterio de ordenación (debido entre otros a los estudios de Henry Moseley) es otro. En ella, los elementos se encuentran ordenados, de izquierda a derecha, por valores crecientes de sus números atómicos (Z). Además de esto, los elementos aparecen distribuidos en filas y columnas.
Existen 7 filas horizontales que se denominanperíodos y 18 columnas verticales que se denominan grupos.
Los elementos también se clasifican en:metales, no metales y semimetales de acuerdo con sus propiedades para ganar o perder electrones.
Átomos, moléculas, iones y cristales
Según las teorías atomistas a la partícula que ya no se puede seguir dividiendo la denominamos átomo.
Un átomo que adquiere o que pierde electrones queda cargado y recibe el nombre de ión.
Los átomos pueden unirse formando cristales o, también, moléculas.
Una molécula está constituida por la unión de dos o más átomos del mismo elemento o de elementos distintos.
Un cristal es una estructura ordenada de átomos, moléculas o iones. Recuerda que los verdaderos sólidos son todos cristales.
Los átomos se pueden unir constituyendo moléculas discretas o, también, cristales.
Los átomos se pueden unir constituyendo moléculas discretas o, también, cristales.
3. Estudio de los elementos
Los gases nobles y la regla del octeto.
El helio, el neón, el argón y kriptón son los primeros elementos de esta familia. Sus moléculas son monoatómicas, es decir, están constituidas por un único átomo.
No reaccionan con los otros elementos, por eso se les denomina también gases inertes.
El helio, después del hidrógeno, es el elemento más abundante de las estrellas producido por la fusión del hidrógeno.
Todos los gases nobles tienen ocho electrones en su último nivel (excepto el Helio que tiene dos).
Los gases nobles no reaccionan con los otros elementos, por eso se les denomina también gases inertes.
El hidrógeno es el elemento más abundante en el Universo.
Actividad interactiva
3. Estudio de los elementos
Los gases nobles no reaccionan con los otros elementos, por eso se les denomina también gases inertes.
El hidrógeno
Es el elemento más abundante del Universo.
Constituye la parte principal de la estrellas y del Sol (que es otra estrella), donde se produce la llamada fusión nuclear que es la responsable de la energía emitida por las estrellas.
Constituye la parte principal de la estrellas y del Sol (que es otra estrella), donde se produce la llamada fusión nuclear que es la responsable de la energía emitida por las estrellas.
En la Tierra es el tercer elemento en importancia y se encuentra combinado con otros elementos como el oxígeno (formando el agua) y al carbono (como hidrocarburos). En estado libre se encuentra en baja proporción en la atmósfera y en forma de molécula diatómica.
El hidrógeno es el elemento más abundante en el Universo.
Los alcalinos
Esta familia incluye los elementos litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Son todos metales sólidos a temperatura ambiente, blandos y forman iones con una carga positiva.
Reaccionan fácilmente con los otros elementos, por eso no se encuentran libres en la naturaleza.
Se oxidan cuando son expuestos al aire y reaccionan violentamente con el agua para formar el correspondiente hidróxido e hidrógeno gaseoso.
Los metales alcalinos son los metales más reactivos de la tabla periódica . |
Los alcalinotérreos
A este grupo pertenecen los elementos berilio (Be), magnesio (Mg), calcio (Ca) y bario (Ba). Son todos metales (como los alcalinos) y forman iones con dos cargas positivas.
Se oxidan fácilmente en contacto con el aire y reaccionan con el agua para formar el correspondiente hidróxido e hidrógeno gaseoso.
Los metales alcalinotérreos adquieren configuración de gas noble al perder dos electrones. |
Actividad interactiva
3. Estudio de los elementos
Los metales de transición
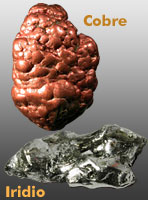
A estos periodos pertenecen los elementos cromo (Cr), manganeso (Mn), hierro (Fe), cobalto (Co), níquel (Ni), cobre (Cu), cinc (Zn), plata (Ag), cadmio (Cd), platino (Pt), oro (Au), mercurio (Hg), wolframio (o tungsteno) (W), titanio (Ti)...
Excepto el mercurio, todos son sólidos a temperatura ambiente. En la naturaleza se encuentran combinados con otros elementos, aunque el oro, el cobre y la plata (los metales acuñables) se pueden encontrar libres. Conducen la corriente eléctrica y el calor fácilmente. Forman iones positivos.
Los metales de transición forman iones positivos de diferentes cargas. |
Los térreos
A este grupo pertenecen los elementos boro (B), el aluminio (Al), el indio (In) y el talio (Tl).
Constituyen más del 7% en peso de la corteza terrestre, sobre todo el aluminio (metal más abundante y tercer elemento más abundante de la corteza después del oxígeno y del silicio). El indio y el talio son muy raros. A temperatura ambiente son sólidos.
Son bastante reactivos, por eso en la naturaleza no se encuentran en estado libre y forman iones con tres cargas positivas. La mayoría de sus minerales son óxidos e hidróxidos y, en el caso del galio, del indio y del talio, se encuentran asociados con minerales de plomo y de cinc.
Los iones de los térreos tienen comúnmente tres cargas positivas. |
Carbonoideos
A este grupo pertenecen los elementos carbono (C), silicio (Si), estaño (Sn) y plomo (Pb). Todos son sólidos cuando no están combinados.
El carbono se encuentra libre en la naturaleza en dos formas alotrópicas: el diamante y el grafito. Combinado con otros elementos, forma los llamados hidrocarburos y los compuestos característicos de la vida: azúcares, proteínas, grasas...
El silicio se encuentra normalmente en forma de óxido: el cuarzo y la sílice.
El estaño y el plomo son dos metales y están combinados en la naturaleza.
El carbono puede formar muchísimos compuestos y es la base de las moléculas relacionadas con la vida. |
Nitrogenoideos
Entre estos elementos se encuentran el nitrógeno (N), el fósforo (P) y el arsénico (As).
El nitrógeno se encuentra en la naturaleza en estado libre (N2) constituyendo el 78% de las moléculas de la atmósfera y combinado con otros elementos formando muchos compuestos (como nitratos y nitritos). Cuando se encuentra en estado libre es muy poco reactivo.
El fósforo es un sólido que se presenta principalmente en dos formas alotrópicas: fósforo rojo y fósforo blanco, normalmente se encuentra combinado formado las sales denominadas fosfatos.
Tanto el nitrógeno como el fósforo o el arsénico forman iones con tres cargas negativas.
El nitrógeno es el elemento más abundante de la atmósfera. |
Anfígenos o calcógenos
El oxígeno (O) y el azufre (S) son los elementos más importantes de este grupo.
El oxígeno se encuentra en la naturaleza en estado libre (O2) constituyendo el 20% de las moléculas de la atmósfera y combinado como óxidos, ácidos o sales.
El azufre es un sólido amarillo que se puede encontrar libre o combinado formando sulfatos, sulfitos y sulfuros.
El oxígeno es el elemento más abundante de la corteza terrestre y de los océanos. |
Halógenos
El flúor, el cloro, bromo y yodo forman parte de este grupo. En la naturaleza están siempre combinados. En estado libre sus moléculas tienen dos átomos: F2, Cl2, Br2, I2.
El elemento flúor es un gas de color amarillo, mientras que el cloro es de color verde, el bromo pardo rojizo y el yodo marrón con brillo.
Todos ellos forman iones con una carga negativa. Con el hidrógeno forman los correspondientes haluros con propiedades ácidas.
A temperatura ambiente, el flúor y el cloro son gases, el bromo es un líquido y el yodo un sólido volátil.
4. Compuestos
¿Qué es un compuesto?
Según sabemos, un compuesto es una sustancia pura que aún se puede separar en otras más simples por métodos (reacciones) químicos.
Por ejemplo, el agua es una sustancia pura, pero si la sometemos a electrolisis (proceso químico) la podemos separar en sus elementos constituyentes: el oxígeno y el hidrógeno.
Tanto en los elementos como en los compuestos los átomos se unen entre si mediante enlaces químicos.
En un compuesto hay átomos de diferentes elementos unidos mediante fuerzas que denominamos enlaces químicos. |
Fórmulas empírica y molecular
La fórmula molecular es la fórmula química que indica el número y tipo de átomos distintos presentes en la molécula. La fórmula molecular es la cantidad real de átomos que conforman una molécula. Sólo tiene sentido hablar de fórmula molecular si el elemento o el compuesto están formados por moléculas; en el caso de que se trate de cristales, se habla de su fórmula empírica.
La fórmula empírica nos muestra la proporción entre los átomos de un compuesto químico. A veces puede coincidir con la fórmula molecular del compuesto. La fórmula empírica se puede usar tanto en compuestos formados por moléculas como en los que forman cristales y macromoléculas.
La fórmula empírica nos informa únicamente de la proporción de átomos en un compuesto.
La fórmula molecular nos informa de los átomos que hay en una molécula.
|
Compuestos binarios
Son los formados por dos elementos diferentes
Los más importantes son:
- Óxidos. Son combinaciones del oxígeno con otro elemento, metálico o no metálico.
- Hidruros. Son combinaciones entre el hidrógeno y otro elemento, metálico o no metálico.
- Sales binarias. Son combinaciones entre un metal y un no metal.
Los compuestos binarios están constituidos por la combinación de dos elementos.
|
Compuestos ternarios
Son los formados por tres elementos diferentes
Los más importantes son:
- Hidróxidos. Son combinaciones de un metal con grupos hidroxilo (OH-). Tienen propiedades antagónicas a los ácidos.
- Ácidos oxoácidos. Son combinaciones entre un no metal con oxígeno e hidrógeno.
- Sales oxisales. Son combinaciones entre un metal, un no metal y oxígeno.
Los compuestos ternarios están constituidos por la combinación de tres elementos.
|
Masa molecular
Tanto los elementos como los compuestos pueden estar formados por moléculas. De la misma forma que estudiaste en quincenas anteriores el concepto de masa atómica (que representábamos por Ar), podemos decir que la masa molecular es la que corresponde a la masa de una molécula.
Lógicamente, la masa de una molécula es pequeñísima, por eso se prefiere usar unidades de masa atómica en lugar del gramo o del quilogramo. Cuando medimos la masa de una molécula en unidades de masa atómica, la simbolizamos como Mr (masa molecular relativa)
Para determinar la masa molecular sumaremos las masas de todos los átomos que constituyen la molécula.
La masa molecular es la masa que tiene una molécula.
Composición centesimal
La composición centesimal de un compuesto es el tanto por ciento en masa de cada uno de los elementos que lo componen.
En el caso de que el compuesto esté constituido por moléculas, para calcular el tanto por ciento en masa de cada elemento dividiremos la masa de cada tipo de átomos que componen la molécula por la masa molecular y multiplicaremos por cien.
Si el compuesto no está formado por moléculas (si es un cristal...), el porcentaje lo obtendremos a partir de su fórmula empírica de la misma forma que lo indicado en el párrafo anterior.
La composición centesimal de un compuesto es el tanto por ciento en masa de cada uno de los elementos que lo componen. |
5. El enlace químico
Concepto
Los átomos pueden unirse entre si formando lo que se llama un enlace químico.
La razón de que los átomos se unan tenemos que buscarla en la mayor estabilidad energética que adquiere el sistema de átomos al unirse: cuanto menor es el contenido en energía de un sistema, mayor estabilidad tiene.
No todos los átomos tienden a unirse, los gases nobles están constituidos por átomos individuales.
La estabilidad energética de los átomos de los gases nobles se atribuye a su estructura electrónica (todos tienen 8 electrones en su último nivel), por ello se usa la regla del octeto para predecir si dos o más átomos formarán un enlace o no.
Los enlaces químicos son las fuerzas entre los átomos que constituyen un elemento o un compuesto. |
Enlace iónico
Este enlace se produce cuando los átomos de los elementos metálicos (los situados más a la izquierda en la tabla periódica, períodos 1, 2 y 3), se encuentran con átomos no metálicos (los situados a la derecha en la tabla periódica, períodos 16 y 17).
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos (cationes) y negativos (aniones), respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. A estas fuerzas eléctricas las llamamos enlaces iónicos.
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos (cationes) y negativos (aniones), respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. A estas fuerzas eléctricas las llamamos enlaces iónicos.
En el enlace iónico, los cationes y aniones de atraen debido a su carga eléctrica.
|
Enlace covalente
Este enlace se produceentre los átomos de los elementos no metálicos (los situados más a la derecha en la tabla periódica, períodos 14, 15, 16 y 17).
En este caso la tendencia a captar electrones es semejante entre los átomos. Los electrones se compartirán entre los átomos para quedar rodeados por 8 electrones (regla del octeto).
Hay dos tipos de sustancias a que da lugar este enlace: sustancias moleculares (formadas por moléculas) como el oxígeno y cristales covalentes como el diamante (donde todos los átomos se encuentran unidos en una red tridimensional).
En el enlace covalente se comparten los electrones entre los átomos unidos.
|
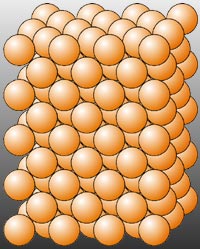
Enlace metálico
Este enlace se produce entre los átomos de los elementos metálicos (los situados en la parte izquierda de la tabla periódica).
En este caso la tendencia es de valencia) se compartirán entre todos los átomos constituyendo lo que se llama nube o mar de electrones. Debido a esto, los metales son buenos conductores de la electricidad.
Los restos iónicos (con carga positiva) se ordenan en una red tridimensional formando uncristal metálico.a ceder electrones es semejante entre los átomos. Los electrones del último nivel (llamados electron
En el enlace metálico, todos los átomos
Nomenclatura y formulación inorgánica
Introducción
Historia
Nomenclaturas
Número oxidación y valencia
Historia
Nomenclaturas
Número oxidación y valencia
2. Aniones
Definición y tipos
Definición y tipos
3. Cationes
Definición y tipos
4. Compuestos binarios
Óxidos
Peróxidos y superóxidos
Hidruros
Sales binarias
5. Compuestos ternarios
HidróxidosDefinición y tipos
4. Compuestos binarios
Óxidos
Peróxidos y superóxidos
Hidruros
Sales binarias
5. Compuestos ternarios
Oxoácidos
Oxisales
6. Compuestos cuaternarios
Sales ácidas
Sales básicas
1. Introducción
Historia
 No es hasta finales del siglo XVIII cuando las sustancias químicas comienzan a recibir nombres lógicos y racionales pues hasta ahora se las nombraba con nombres, heredados de la alquimia.
No es hasta finales del siglo XVIII cuando las sustancias químicas comienzan a recibir nombres lógicos y racionales pues hasta ahora se las nombraba con nombres, heredados de la alquimia.En 1780 Lavoisier junto con otros tres químicos franceses, Guyton de Morveau, Berthollet y Fourcony inician la creación de un sistema de nomenclatura más lógico y racional que sustituya al heredado de los alquimistas. La empresa ve la luz cuando Lavoisier publica su Tratado Elemental de Química en el que expone de forma organizada y sistemática la nueva nomenclatura.
A principios del siglo XIX, Berzelius asigna a cada elemento un símbolo que coincide con la inicial del nombre en latín. Así pues, las fórmulas de las sustancias consistirían en una combinación de letras y números que indican el número de átomos de cada elemento.
Nomenclaturas
 Al existir una gran variedad de compuestos químicos es necesario desarrollar un método que permita entenderse y evite que un mismo compuesto sea nombrado de formas distintas según el criterio personal.
Al existir una gran variedad de compuestos químicos es necesario desarrollar un método que permita entenderse y evite que un mismo compuesto sea nombrado de formas distintas según el criterio personal.La nomenclatura actual está sistematizada mediante las reglas propuestas por la IUPAC(Internacional Union of Pure and Applied Chemistry).
En esta quincena, aprenderemos a nombrar y a formular los compuestos químicos inorgánicos de tres maneras: Sistemática, de Stock y Tradicional.
Aunque según la IUPAC la nomenclatura sistemática es de uso obligatorio, también es necesario conocer la de Stock y la tradicional ya que para determinados compuestos, como los oxoácidos y oxisales, son admitidas.
Aunque según la IUPAC la nomenclatura sistemática es de uso obligatorio, también es necesario conocer la de Stock y la tradicional ya que para determinados compuestos, como los oxoácidos y oxisales, son admitidas.
Número de oxidación y valencia
La valencia de un átomo o elemento es el número que expresa la capacidad de combinarse con otros para formar un compuesto. Es siempr
e un número positivo.El número de oxidación es un número entero que representa el número de electrones que un átomo gana o pierde cuando forma un compuesto determinado.
Es positivo si el átomo pierde o comparte electrones con un átomo que tenga tendencia a captarlos y negativo si el átomo gana o comparte electrones con un átomo que tenga tendencia a cederlos.
| 2. Aniones | |
Definición y tipos
Un anión es un átomo o conjunto de átomos con carga negativa. Esta carga negativa es lo que se considera su valencia.
Aniones -uroLos aniones pueden ser: Aniones -ato Aniones -ito Aniones per-ato Aniones hipo-ito Aniones di, tri, tetra... Aniones orto Aniones piro Aniones meta  |
http://rincones.educarex.es/fyq/index.php/estructura-atomica-y-cambios-quimicos/actividades
|
|---|
|
de cuál debe ser el valor que más se aproxima al valor que realmente tiene la magnitud medida.
| ||
Musica
http://www.youtube.com/watch?feature=player_embedded&v=If_T1Q9u6FM
http://criscordero.files.wordpress.com/2013/11/sin-tc3adtulo.png?w=408&h=217
https://www.youtube.com/watch?feature=player_embedded&v=ukZWoAy2QO4





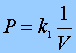















No hay comentarios:
Publicar un comentario
Gracias por su colaboración