.Haz doble clic en las actividades interactivas para entrar
El calor, la temperatura
Propiedades
Actividad interactiva
Aspectos cualitativos
Antecedentes históricos: Los filósofos griegos, Demócrito y Epicuro, consideraban que la materia
es divisible en la experiencia diaria, pero, en un cierto término, consta de partículas indivisibles que
podemos provisionalmente llamar átomos (de la palabra griega átomo, indivisible).
El físico inglés J. Dalton (1766-1844) establece laTeoría atómica de la materia en la que se considera
que todo tipo de materia, sea sólido, líquido o gas, está constituida por partículas, que en principio
se llamaron átomos.
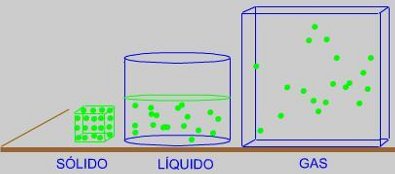
En un SÓLIDO, estas "partículas" ocupan posiciones determinadas en una red, alrededor de las
cuales vibran cada vez más intensamente a medida que aumentamos la temperatura. Las fuerzas
atractivas entre las partículas del sólido son muy intensas.
En un LÍQUIDO, estas "partículas" se mueven deslizándose unas cerca de otras y manteniéndose
unidas por débiles fuerzas atractivas entre ellas.
En el caso de un GAS, estas "partículas" se mueven a grandes velocidades y las fuerzas atractivas
entre ellas podemos considerarlas como inexistentes. Se mueven al azar ocupando todo el volumen
del recipiente.
Modelo de gas ideal
Como vamos a estudiar el comportamiento de los gases, vamos a establecer un MODELO para
cualquier gas, que, como hemos visto en las anteriores animaciones, estará constituido por partículas
moviéndose al azar y chocando contra las paredes del recipiente. Las características de nuestro
MODELO ideal de gas serán:
Presión. Unidades
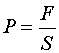

El calor, la temperatura
Propiedades
La materia que nos rodea aparece ante nosotros con muy diversos aspectos.
Presenta distintas formas, colores, dureza, fluidez..., pero en general consideraremos
que lo hace en los siguientes estados:
SÓLIDO, LÍQUIDO y GAS
El estado gaseoso , igual que los líquidos, se adaptan a su recipiente, pero
los gases, pueden además comprimirse y descomprimirse, lo que no puede
hacerse con los líquidos
|
Aspectos cualitativos
Antecedentes históricos: Los filósofos griegos, Demócrito y Epicuro, consideraban que la materia
es divisible en la experiencia diaria, pero, en un cierto término, consta de partículas indivisibles que
podemos provisionalmente llamar átomos (de la palabra griega átomo, indivisible).
El físico inglés J. Dalton (1766-1844) establece laTeoría atómica de la materia en la que se considera
que todo tipo de materia, sea sólido, líquido o gas, está constituida por partículas, que en principio
se llamaron átomos.
En un SÓLIDO, estas "partículas" ocupan posiciones determinadas en una red, alrededor de las
cuales vibran cada vez más intensamente a medida que aumentamos la temperatura. Las fuerzas
atractivas entre las partículas del sólido son muy intensas.
En un LÍQUIDO, estas "partículas" se mueven deslizándose unas cerca de otras y manteniéndose
unidas por débiles fuerzas atractivas entre ellas.
En el caso de un GAS, estas "partículas" se mueven a grandes velocidades y las fuerzas atractivas
entre ellas podemos considerarlas como inexistentes. Se mueven al azar ocupando todo el volumen
del recipiente.
Haz clic sobre la imagen para ver las partículas de cada cuerpo en movimiento.
¿Ves las diferentes características de este movimiento según el estado en que se encuentre la materia?
En las páginas siguientes trataremos de entender el comportamiento de las partículas de los gases.
|
Como vamos a estudiar el comportamiento de los gases, vamos a establecer un MODELO para
cualquier gas, que, como hemos visto en las anteriores animaciones, estará constituido por partículas
moviéndose al azar y chocando contra las paredes del recipiente. Las características de nuestro
MODELO ideal de gas serán:
-Las partículas del gas son pequeñísimas comparadas con el volumen del recipiente.
-Se mueven al azar con distintas velocidades de manera que, si aumenta la temperatura, aumenta la velocidad de las partículas del gas.
- No existen fuerzas de atracción entre ellas.
- En su movimiento, chocan entre ellas y con las paredes del recipiente cumpliéndose las leyes de los choques elásticos.
- Cuando chocan aparecen las fuerzas o interacciones entre ellas o con las paredes del recipiente.
- Los choques con las paredes del recipiente producen el efecto que llamamos presión sobre las mismas.
Actividad interactivaPresión. Unidades
Se define la magnitud física llamada PRESIÓN como una fuerza por unidad de superficie, es decir:
Su unidad en el Sistema Internacional (SI) , es el PASCAL y cuyo símbolo es Pa y equivale a:
Pa = 1N/1m2
El PASCAL es una unidad de presión muy pequeña, por lo que se suelen usar otras unidades
de presión. Entre ellas tenemos:
La atmósfera cuyo símbolo será atm y que equivale a una cantidad de Pascales de:
1 atm = 101.325 Pa o lo que es lo mismo 1013 hPa . El hPa se llamaba antes milibar.
Por último también se utiliza el Torr que equivale a 1 mm de mercurio, con lo que:
1 atm = 101.325 Pa = 1013 hPa = 760 Torr
|
| Factores que regulan la presión | |
Según el MODELO de gas que hemos propuesto, la PRESIÓN (fuerza que por unidad de superficie de pared de recipiente ejercen las partículas del gas al chocar contra ellas) puede depender de una serie de factores que pueden ser:
|
Factores que regulan la presión
Como hemos visto, la PRESIÓN que ejerce un gas sobre las paredes del recipiente, depende de
tres factores:
Del nº de partículas de gas (cantidad de gas considerada). A más partículas más presión.
Delvolumen del recipiente. A mayor volumen, menor presión. De la temperatura del gas.
A mayor temperatura, mayor velocidad de las partículas del gas y por tanto mayor presión.
Es decir: P = f ( V , t , nº de partículas)
Si queremos comprobarlo experimentalmente, como la presión depende de tres variables,
tendremos que planear experiencias en las que, manteniendo constantes dos de ellas,
variemos sólo una de ellas. Eso es lo que hicieron Boyle, Gay-Lussac y Charles
1ª Experiencia. Manteniendo constante la cantidad de gas (nº de partículas) y la temperatura
del gas, variaremos del volumen del gas y para cada volumen mediremos la presión : nº part=cte,
t = cte, P =f(V). Con ella llegaremos a la ley de BOYLE.
2ª Experiencia. Manteniendo constante la cantidad de gas (nº de partículas) y el Volumen del
recipiente, variaremos la temperatura en ºC del gas y, para cada temperatura mediremos la
presión: nº part=cte, V=cte, P=f(t). Con ella llegaremos a la ley de GAY-LUSSAC.
3ª Experiencia. Manteniendo constantes el volumen del recipiente y la temperatura del
gas, variaremos el nº de partículas del gas, y para cada valor mediremos la presión:
V=cte, t=cte, P=f(nº de partículas), con ella podremos completar la ecuación de estado
del gas IDEAL.

No hay comentarios:
Publicar un comentario
Gracias por su colaboración